Bei den Simulationsanwendungen unterscheidet man die stationäre und die dynamische Simulation. Grundsätzlich brauchen aber alle Simulationsprogramme in der chemischen Industrie eine entsprechende Stoffdatenbank und thermodynamische Methoden, so dass man bei Gemischen den Anteil der Dampf- und der Flüssigphase berechnen kann.
Simulationsprogramme
Hier habeich ein paar Links zusammengestellt mit den auf dem Markt erhältlichen Simulationsprogrammen und ihre Anbieter:
1. PRO/II von Simulation Sciences www.simsci-esscor.com
2. Aspen Plus von Aspen Tech www.aspentech.com
3. UniSim von Honeywell http://hpsweb.honeywell.com/Cultures/en-US/Products/ControlApplications/Simulation/default.htm
4. Chemshare http://www.chemshare.com/index.html
5. Petro-SIM von KBC www.kbc.com
Stoffdatenbanken werden in Deutschland von der DECHEMA verwaltet www.dechema.de. In Amerika ist NIST sehr bekannt http://webbook.nist.gov .
Eine kleine Einführung in die Thermodynamik
Wenn zwei oder mehr Phasen in Kontakt zueinander stehen, so werden Moleküle von einer in die andere Phase transportiert, bis sich ein Gleichgewicht, das sogenannte Phasengleichgewicht, einstellt und die Zusammensetzung der einzelnen Phasen konstant bleibt. Ist ein Mehrkomponentensystem im Gleichgewicht, so ist die Temperatur, der Druck und das chemische Potential einer Komponente i in jeder Phase gleich. Es gilt:
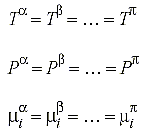
Mit
T = Systemtemperatur
P = Systemdruck
m = das chemische Potential
a, b, ..., p gibt die Phase wieder
Die Fugazität eines Stoffes ist definiert als:
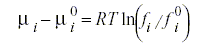
fi = Fugazität des Stoffes i
fi0= Fugazität des Stoffes i bei Standardbedingungen
mi0= chemsiches Potential des Stoffes i bei Standardbedingungen
Aus den oben genannten Gleichungen folgt, dass die Fugazitäten in jeder Phase gleich sein müssen:
![]()
Man kann sich die Fugazität als einen “korrigierten Partialdruck” vorstellen, d.h. dass die Fugazität eines Stoffes in einem idealen Gas gleich dem Partialdruck dieser Komponente ist. Zur Berechnung von Dampf-Flüssig-Gleichgewichten hat man das molaren Anteil eines Stoffes in der Dampfphase zu dem molaren Anteil des Stoffes in der Flüssigphase als K-Wert definiert.
![]()
Ki = K-Wert, oder Gleichgewichtsverhältnis
yi = molarer Anteil des Stoffes i in der Dampfphase
xi = molarer Anteil des Stoffes i in der Flüssigphase
Für die Berechnungen des Gleichgewichtes werden in der Regel zwei unterschiedliche Methoden angewandt, die Zustandsgleichung (Equation of State EOS) und die Aktivitätskoeffizientenmethode (Liquid Activity Method LAM). Beispiel für eine EOS ist Soave-Redlich-Kwong, kurz SRK und die am meisten angewandte LAM ist Non-Random-Two-Liquids, kurz NRTL.
Zustandsgleichung
Zustandsgleichungen zur Berechnung von Damp-Flüssig-Gleichgewichten können über einen großen Temperatur- und Druckbereich angewandt werden. Thermodynamische Eigenschaften wie Enthalpie und Entropie lassen sich ebenfalls berechnen. Als Referenzzustand dient das Ideale Gas Gesetz und die Abweichung vom Zustand des idealen Gases wird über die Fugazitätskoeffizienten für beide Phasen berechnet. Bei den kubischen Zustandsgleichungen können kritische und überkritische Bedingungen gut berechnet werden. Eine kubische Zustandsgleichung mit zwei Parametern kann wie folgt aufgestellt werden:
![]()
mit
P = Druck
T = absolute Temperatur
v = molares Volumen
u,w = Konstanten
Typische Werte für u und w sind:
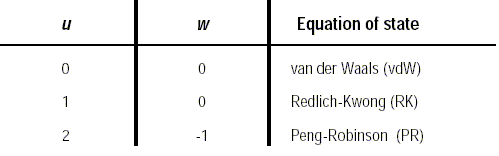
Die Parameter a und b an der kritischen Temperatur erhält man indem die erste und zweite Ableitung des Druckes in Abhängigkeit vom Volumen am kritischen Punkt zu null gesetzt wird. Daraus ergeben sich folgende Gleichungen:
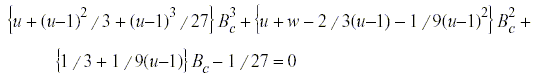
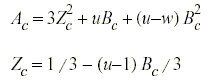
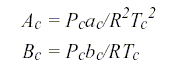
mit dem c als Indizes für den kritischen Punkt.
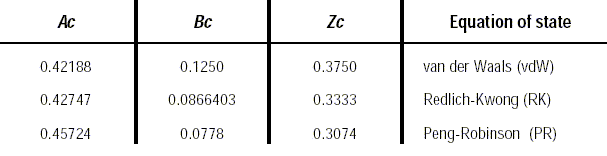
Van der Waals, Redlich-Kwong und Peng-Robinson berechnen für Ac, Bc und Zc die folgenden Werte:
Copyright © 2007 caspar-engineering.de